Extrazelluläre Vesikel (EVs) sind verschiedene membranstrukturierte vesikuläre Strukturen (40–100 nm), die von Zellen freigesetzt werden. Aufgrund ihrer geringen Immunogenität, biologischen Abbaubarkeit, geringen Toxizität und der Fähigkeit, die Blut-Hirn-Schranke zu überwinden, gelten EVs als potenzielle Wirkstoffträger in den Bereichen Immuntherapie, regenerative Medizin usw. und haben sich als Vehikel für neuartige Arzneimittelverabreichungssysteme etabliert.
Zirkuläre RNA DYM (circDYM) stammt aus den Exons 4, 5 und 6 des DYM-Gens. Es kann als „Schwamm“ für miRNA 9 fungieren, um miRNA zu adsorbieren und zu hemmen und spielt somit eine regulatorische Rolle. Im Jahr 2018 entdeckte das Forschungsteam unter der Leitung von Yao Honghong vom Department of Pharmacology der School of Medicine der Southeast University, dass die Überexpression von circDYM im Hippocampusbereich die Aktivität von miRNA 9 hemmen und so letztendlich die Aktivierung von Mikrogliazellen verringern und depressionsähnliche Verhaltensweisen lindern kann.

Am 13. Januar 2022 konstruierte das Forschungsteam unter der Leitung von Yao Honghong auf Grundlage der oben genannten Forschungsergebnisse extrazelluläre Vesikel, die auf das zentrale Nervensystem abzielen und circDYM (RVG-circDYM-EVs) einkapseln. Diese Vesikel lindern wirksam depressionsähnliche Verhaltensstörungen, die durch chronischen Stress verursacht werden. Es gelang ihnen, zirkuläre RNA zu einem Nukleinsäure-Medikament zu entwickeln.
2011 wurde eine neue Methode zur gezielten siRNA-Freisetzung mittels Exosomen entwickelt. Das Oberflächenmembranprotein lamp2b von Exosomen wurde modifiziert und mit dem neuronenspezifischen Tollwutvirus-Glykoprotein (RVG) fusioniert, um Exosomen mit dem RVG-lamp2b-Fusionsprotein zu bilden. Mittels Elektroporation gelangte exogene kurzkettige RNA-Interferenz in die Exosomen. Das RVG auf der Oberfläche der Exosomen bindet an den Acetylcholinrezeptor, um die kurzkettige RNA-Interferenz gezielt in Neuronen freizusetzen und so die Expression von BACE1, einem mit der Alzheimer-Krankheit in Zusammenhang stehenden Protein, signifikant zu reduzieren.
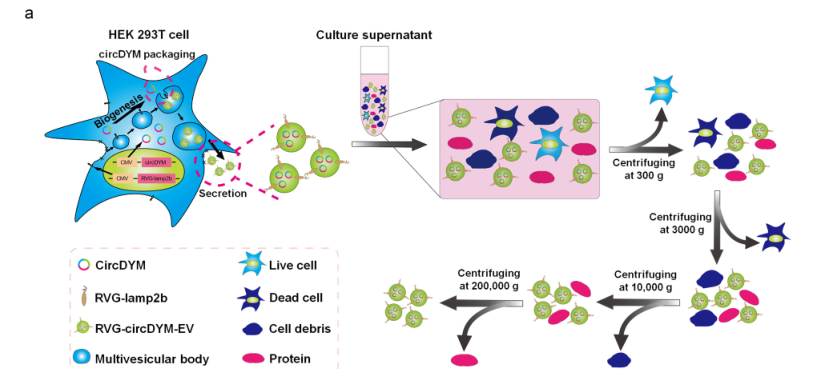
Mit einer ähnlichen Methode konstruierten die Forscher das RVG-circDYM-EVs-System. Mithilfe von Exosomen als Träger erreichten sie die Überexpression von circDYM mit nikotinischer Acetylcholinrezeptor-Ansteuerung (Abbildung 1). Zwei Stunden nach der Schwanzveneninjektion von 200 μg RVG-circDYM-EVs begann sich dieses Exosomensystem in Leber, Nieren, Herz, Milz, Gehirn und anderen Teilen der Mäuse anzureichern (Abbildung 2). Die Leber wies dabei die höchste Anreicherung und Expression auf. Mit der Zeit nahm der Gehalt an Exosomen allmählich ab.
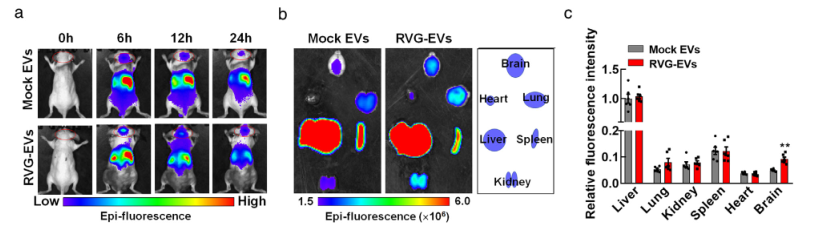
Darüber hinaus können RVG-circDYM-EVs spezifisch auf Mikroglia, Neuronen und Astrozyten im Hippocampus exprimiert werden. Dies deutet darauf hin, dass die Exosomen mit einer auf den nikotinischen Acetylcholinrezeptor gerichteten Überexpression von circDYM die Blut-Hirn-Schranke durchdringen und in das Mäusehirn gelangen können und dort gleichmäßig verteilt sind.
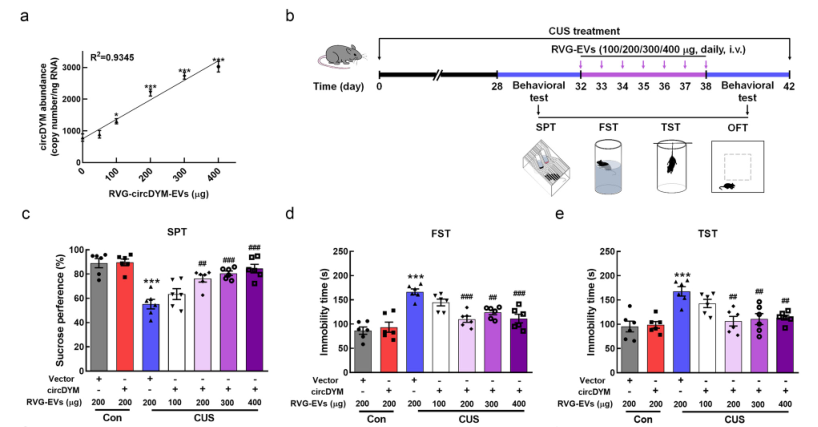
In-vitro-Zellexperimente zeigten, dass RVG-circDYM-EVs die durch Lipopolysaccharide induzierte Aktivierung von Mikroglia reduzieren konnten: die Expression von iNOS, IL-6, IL-1β und MCP - 1 verringert. Anschließend wurden nach Schwanzveneninjektion von 100, 200, 300 und 400 μg RVG - circDYM - EVs an Mäuse mit depressionsähnlichem Verhalten durch chronischen Stress, die 200, 300 und 400 μg-Dosisgruppen konnten das depressionsähnliche Verhalten der Mäuse signifikant verbessern (Abbildung 3).
Um den molekularen Mechanismus, durch den RVG-circDYM-EVs die Aktivität von Mikroglia regulieren, weiter zu erforschen, fanden die Forscher durch Einzelzellsequenzierung heraus, dass der Transkriptionsfaktor TATA-Box-Bindungsprotein-assoziierter Faktor 1 (TAF1) mehr als zehn unterschiedlich exprimierte Gene regulieren und mit circDYM interagieren kann, wobei er sich im Zytoplasma der Mikroglia befindet. In-vitro-Experimente zeigten, dass eine Überexpression von TAF1 die Expression von Trpm6 und Cyp39a1 förderte, während eine Überexpression von circDYM diesen fördernden Effekt hemmen konnte.
Lipopolysaccharide könnten die Bindung von TAF1 an die Promotoren von Trpm6 und Cyp39a1 fördern, und ein Knockdown von Trpm6 oder Cyp39a1 könnte den durch Lipopolysaccharide verursachten Anstieg der iNOS-Spiegel blockieren. Diese molekularen Experimente zeigten, dass circDYM die Aktivierung von Mikroglia durch TAF1 direkt regulieren könnte.
Chronischer Stress kann zu einer verminderten Expression von Tight-Junction-Proteinen im Hippocampus, einer erhöhten Durchlässigkeit der Blut-Hirn-Schranke und letztlich zur Infiltration peripherer Immunzellen wie CD4-positiven T-Zellen, CD8-positiven T-Zellen und B220-positiven B-Zellen in das Hirnparenchym führen. Die Behandlung mit RVG-circDYM-EVs könnte die Blut-Hirn-Schranke teilweise reparieren und die Infiltration peripherer Immunzellen reduzieren.
Es wird berichtet, dass für die in diesem Artikel entwickelten RVG-circDYM-EVs am 13. Februar 2020 ein Patent angemeldet wurde. Der Name der Anmeldung lautet: Exosomen mit gezielter Überexpression von circDYM auf den nikotinischen Acetylcholinrezeptor und ihre Herstellungsmethoden und Anwendungen.