Unser leitendes Wissenschaftlerteam hat einen neuartigen Regulationsmechanismus der „Immunzell-Darm-Hirn-Achse“ während des Auftretens von Depressionen aufgedeckt.
Am 19. November 2025 veröffentlichte die Forschungsgruppe um Professor Yao Honghong und Professor Han Bing von der Medizinischen Fakultät der Southeast University in Zusammenarbeit mit dem Team von Professor Yuan Yonggui vom Zhongda-Krankenhaus der Southeast University den Artikel „Migration von CD8+TSCM-Zellen in den Darm durch verstärkte PPBP-CXCR2-Achse“ in Nature Communications mit einem Impact-Faktor von 16,6/Q1. Der Forschungsartikel „Wirtsstressanfälligkeit durch Hemmung der aus dem Darmmikrobiom stammenden Homovanillinsäure“ befasst sich mit der Frage, wie diese Anfälligkeit reduziert werden kann.Es geht um die grenzüberschreitende Regulation von CD8⁺T-Zell-Subpopulationen und der Darmmikrobiota. Der Versuch, das Kernrätsel des Ausbruchs von Depressionen zu lösen.

Diese Studie hat durch die Analyse klinischer Proben, die Validierung an Tiermodellen und die Kombination verschiedener Omics-Techniken erstmals einen neuen Pathomechanismus für Depressionen umfassend aufgezeigt: die „CD8⁺-Stammzell-ähnliche Gedächtnis-T-Zellen (CD8⁺-TSCM-Zellen) – PPBP-CXCR2-Achse – Darmbakterien – erhöhte Vanillinsäurekonzentration (HVA) – Neuroinflammation“. Sie liefert damit völlig neue Zielstrukturen und eine theoretische Grundlage für die gezielte Behandlung von Depressionen.
Hauptinhalt & Ergebnisse
Diese Studie analysierte systematisch den synergistischen Effekt der peripheren Immunität und der Darmmikrobiota in der Pathogenese von Depressionen mittels einer Kombination aus multizentrischer klinischer Kohortenanalyse und Tierversuchen. Das Forschungsteam untersuchte zunächst die Immunzellen im peripheren Blut von 115 Patienten mit Depressionen und 115 gesunden Kontrollpersonen. Dabei zeigte sich, dass der Anteil an T-Zellen im peripheren Blut von Patienten mit Depressionen signifikant erhöht war und positiv mit dem Schweregrad der depressiven Symptome korrelierte. Mithilfe der Einzelzell-RNA-Sequenzierung (scRNA-seq) wurden CD8+ TSCM-Zellen als die zentrale Immunzellpopulation identifiziert, die die depressive Pathologie vorantreibt. Die Anzahl dieser Zellen war bei Patienten mit Depressionen signifikant erhöht, und ihr Anteil korrelierte eng mit klinischen Symptomen wie dem Hamilton-Depressionsskala-Wert (HAMD-24), Hoffnungslosigkeit und Schlafstörungen. Zudem weisen diese Zellen einzigartige Transkriptomeigenschaften auf.
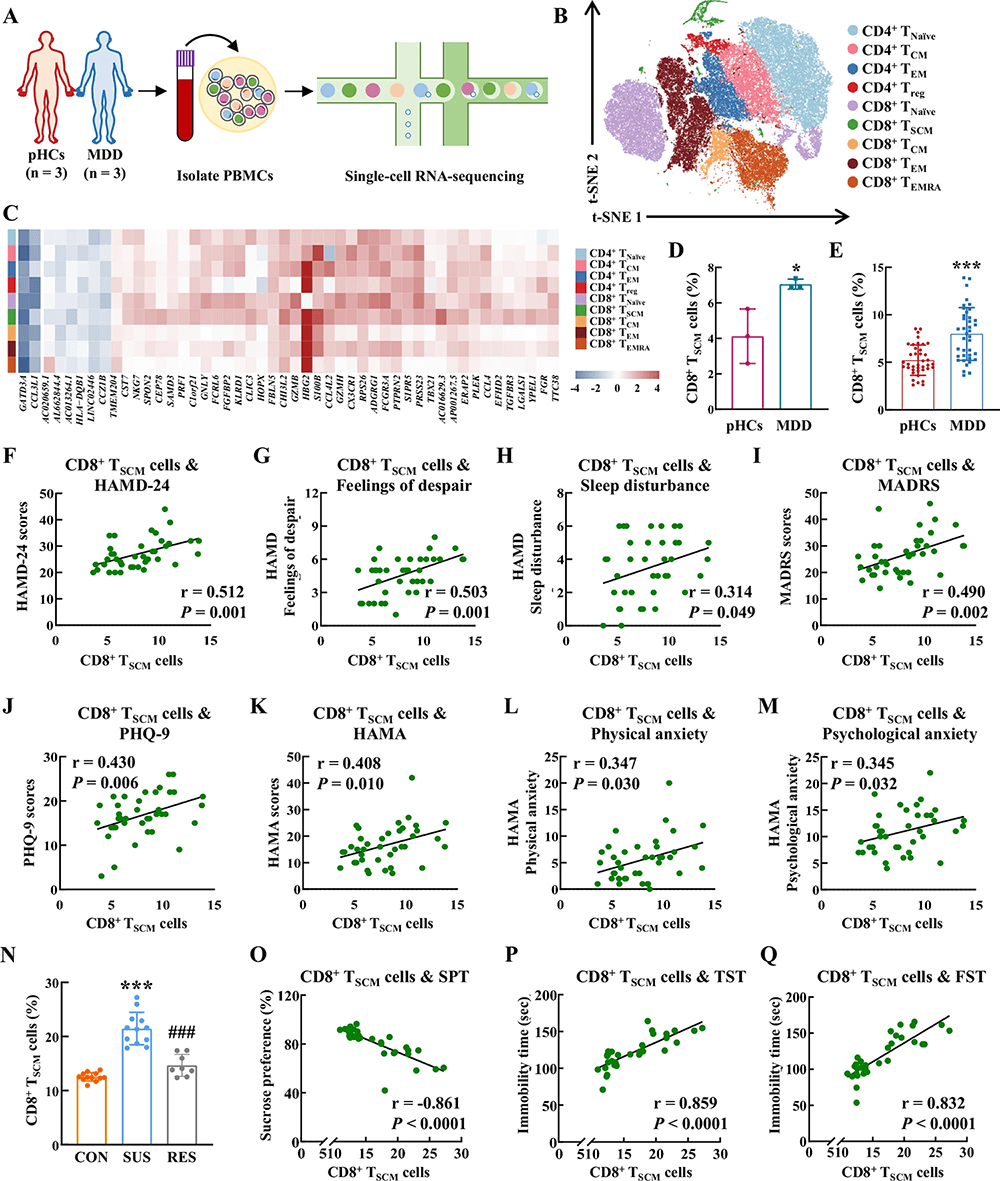
Abbildung 1 CD8+TSCM-Zellen erhöhen die Stressanfälligkeit des Wirts
Um die Migration von CD8+ TSCM-Zellen in vivo zu verfolgen, nutzte das Forschungsteam eine innovative vDISCO-Ganzkörper-Immunmarkierungstechnik und entdeckte unerwartet, dass diese Zellen nicht direkt ins Gehirn einwanderten, sondern entlang der PPBP-CXCR2-Achse gerichtet in den Darm wanderten. Mechanismusstudien bestätigten, dass das in CD8+ TSCM-Zellen stark exprimierte basische Thrombozytenprotein (PPBP) an seinen Rezeptor CXCR2 bindet und ein wichtiger molekularer Signalweg für die Zellmigration in den Darm ist. Dieser Migrationsprozess lässt sich durch die Gabe des CXCR2-Inhibitors SB265610 oder durch die Hemmung des PPBP-Gens signifikant blockieren.
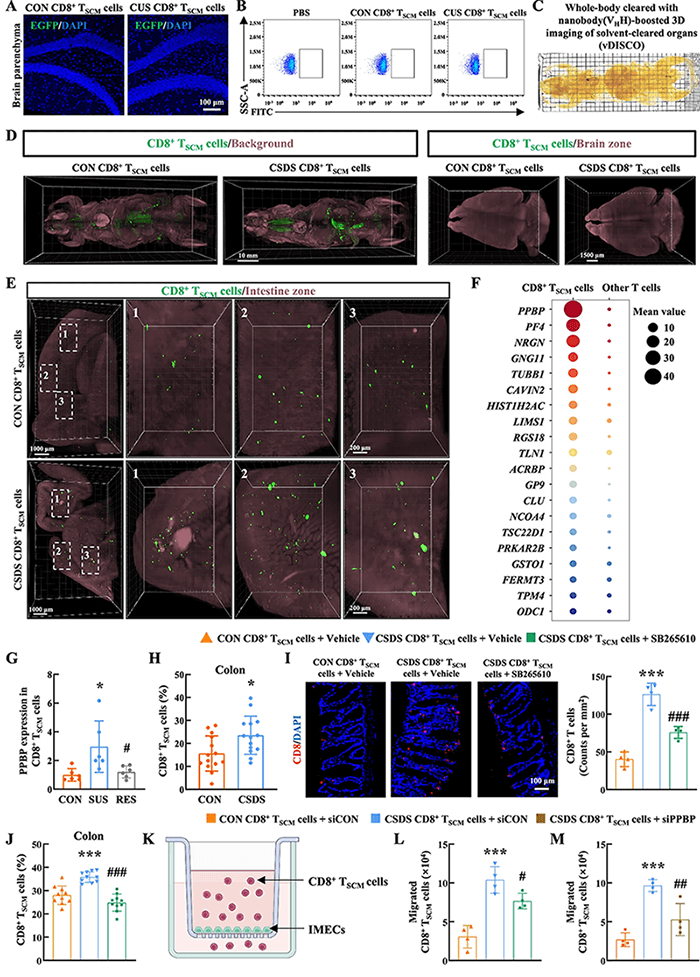
Abbildung 2 Die PPBP-CXCR2-Interaktion vermittelt die Migration von CD8+TSCM-Zellen in den Darmtrakt
Der Darm ist der zentrale Ort, an dem CD8+ TSCM-Zellen ihre pathologischen Wirkungen entfalten. Studien haben gezeigt, dass in den Darmtrakt einwandernde CD8+ TSCM-Zellen Darmentzündungen verursachen, die Menge an Tyrosin-metabolisierenden Bakterien (insbesondere Bifidobacterium skadotropi) reduzieren und dadurch die Produktion von Vanillinsäure (HVA), einem Stoffwechselprodukt der Darmflora, verringern können. HVA, der Hauptmetabolit von Dopamin, ist im Plasma und in der Darmmikrobiota von Patienten mit Depressionen signifikant reduziert. Die exogene Gabe von HVA kann depressionsähnliches Verhalten bei Mäusen mit chronischem sozialem Stress (CSDS) wirksam verbessern.
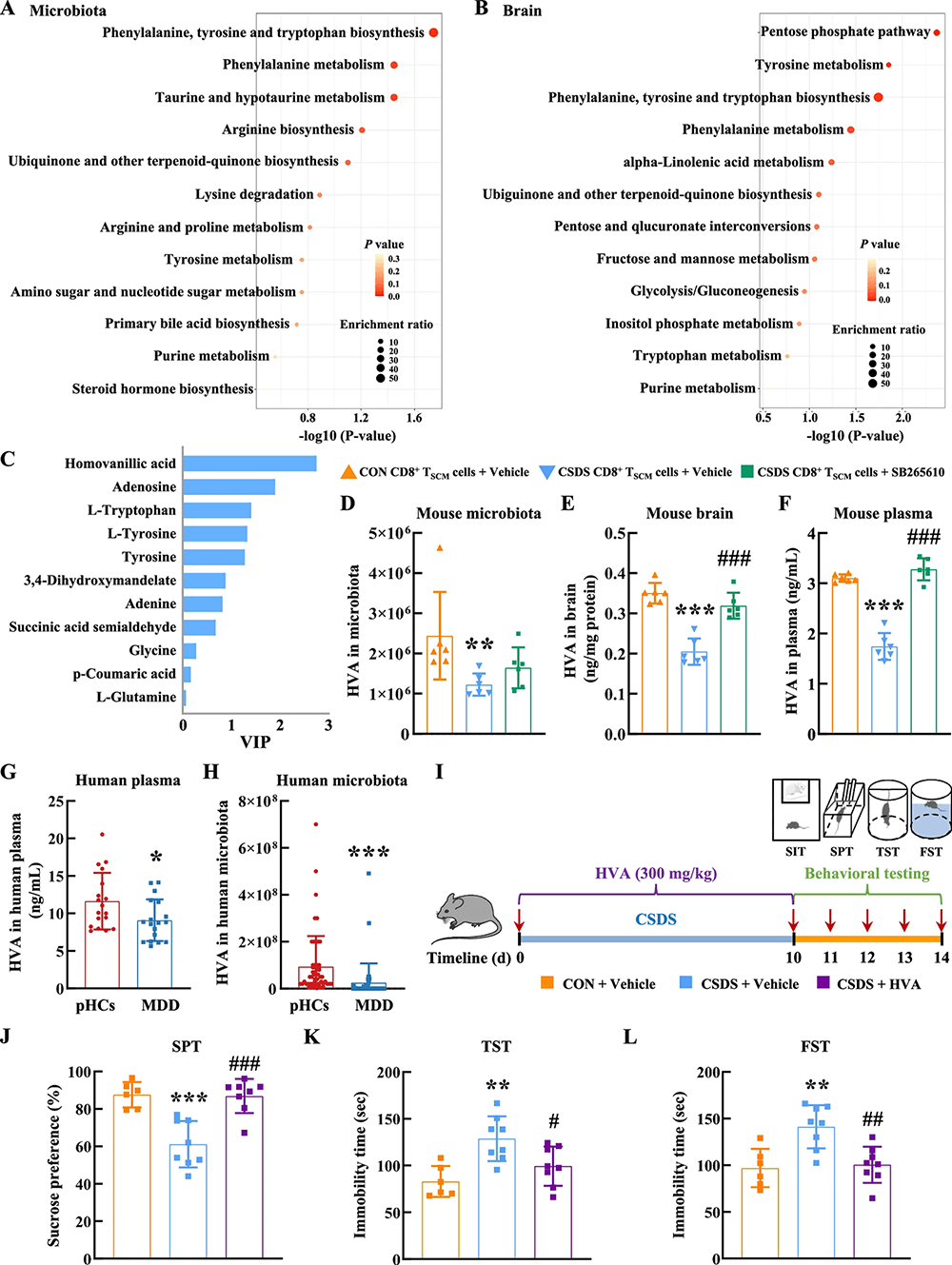
Abbildung 3: Die Blockade von CXCR2 milderte die durch pathologische CD8+ TSCM-Zellen hervorgerufene Reduktion hoher Oxalsäurewerte im Gehirn.
Weitere Untersuchungen der zugrundeliegenden Mechanismen deuten darauf hin, dass ein Abfall des HVA-Spiegels Neuroinflammation im Gehirn auslösen kann, was zu einer abnormalen Funktion von Astrozyten und einer übermäßigen Aktivierung von Mikroglia im Hippocampus führt. Gleichzeitig wird die Expression des synaptischen Proteins SYN1 und des vom Gehirn stammenden neurotrophen Faktors BDNF herunterreguliert, wodurch letztendlich die neuronale Plastizität gestört und depressionsähnliche Verhaltensweisen ausgelöst werden. CXCR2-Inhibitoren stellen nicht nur den HVA-Spiegel wieder her, sondern lindern auch signifikant die Neuroinflammation und verbessern die synaptische Funktion, wodurch sie ein ausgezeichnetes antidepressives Potenzial aufweisen.
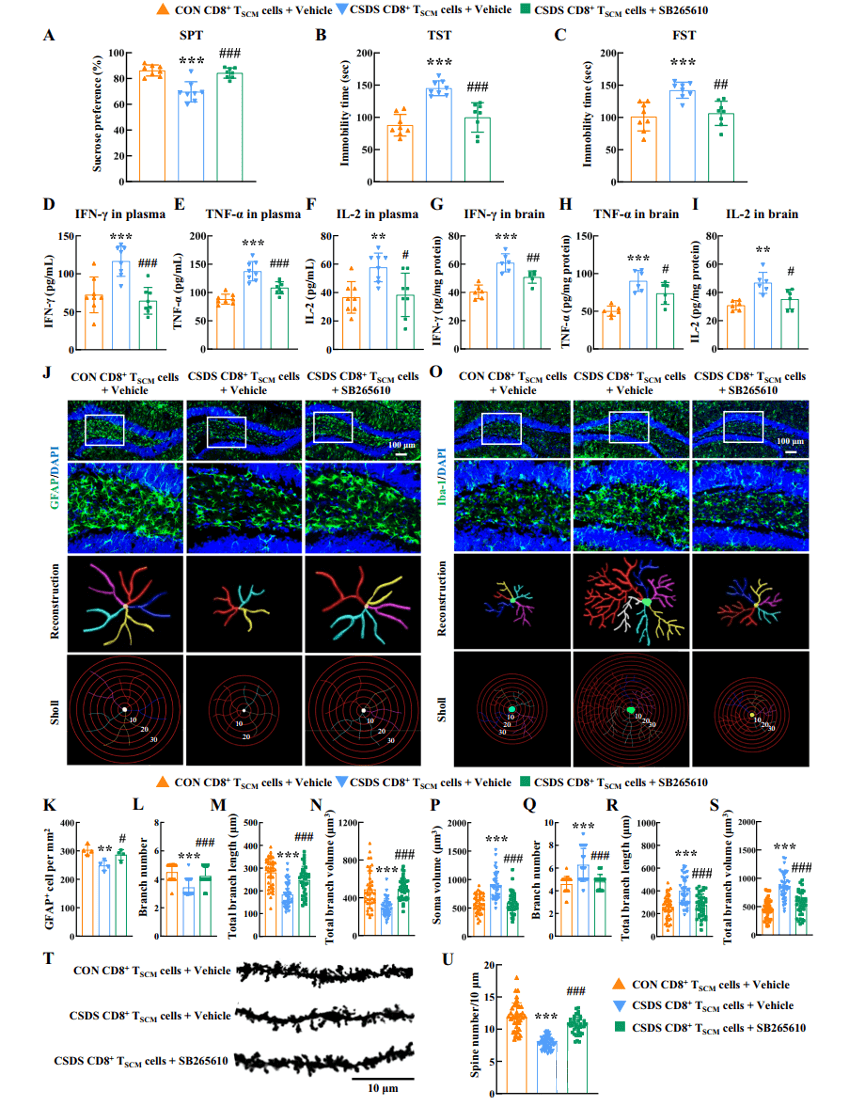
Abbildung 4: Die Blockade von CXCR2 linderte die Neuroinflammation und verbesserte die depressiven Symptome.
Innovationshighlights und Bedeutung
Diese Studie hat anhand der gesamten Kette von klinischen, grundlagenwissenschaftlichen und translationalen Untersuchungen erstmals einen völlig neuen Mechanismus aufgezeigt, durch den CD8+ TSCM-Zellen entlang der PPBP-CXCR2-Achse in den Darmtrakt wandern, dort die HVA-Produktion durch Tyrosin-metabolisierende Darmbakterien hemmen und dadurch Neuroinflammation und Depression auslösen. Sie widerlegt das traditionelle Verständnis, dass „die direkte Infiltration von Immunzellen ins Gehirn zu Depressionen führt“. Stattdessen eröffnet sie eine völlig neue immun-metabolische Perspektive auf die Regulation von Depressionen durch die Darm-Hirn-Achse.
Die Forschung identifizierte CD8+ TSCM-Zellen nicht nur als potenzielle Biomarker für Depressionen, sondern lieferte auch zahlreiche neue Angriffspunkte für die Behandlung von Depressionen. Diese Erkenntnisse bieten eine wichtige theoretische Grundlage und experimentelle Belege für die Entwicklung neuer Antidepressiva, insbesondere für Interventionsmethoden zur Behandlung therapieresistenter Depressionen.